
近日,天美平台生命科學學院余巍研究員與上海交通大學醫學院附屬新華醫院崔龍教授課題組合作發現長壽基因SIRT3調控一碳單位代謝酶參與結直腸癌發生的新分子機製,為開發治療結直腸癌的靶向藥物提供了堅實的理論基礎。10月26日,相關研究成果以《SIRT3去乙酰化絲氨酸羥甲基轉移酶2(SHMT2)促進結直腸癌的發生》為題(“Deacetylation of Serine Hydroxymethyl-transferase 2 by SIRT3 promotes Colorectal Carcinogenesis”)在線發表在《自然·通訊》(Nature Communications)雜誌上⛔。
研究人員發現🤶,線粒體主要去乙酰化酶SIRT3在葡萄糖饑餓的情況下📩,能直接結合一碳單位代謝通路中一個關鍵代謝酶-絲氨酸羥甲基轉移酶2(SHMT2)🚉,並能去除SHMT2 K95的乙酰化修飾,穩定SHMT2的細胞內表達以及維持SHMT2的高活性。SHMT2主要負責細胞內絲氨酸和甘氨酸的相互轉換,高活性的SHMT2能幫助細胞抵抗線粒體的活性氧壓力,並保證細胞內生物大分子的供應從而滿足癌細胞快速增殖的需要。
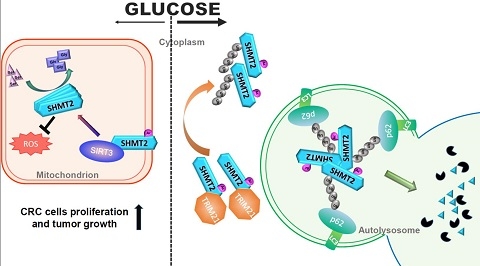
圖1. 模式圖(低葡萄糖促進SIRT3去乙酰化SHMT2,幫助提供細胞快速增殖需要的氨基酸;高葡萄糖導致高度乙酰化的SHMT2,進入溶酶體降解,抑製細胞快速增殖)
研究人員在結直腸癌病人樣本中發現⛓,SIRT3和SHMT2協同高表達✹,相應地SHMT2 K95的乙酰化程度低👞。高表達SIRT3或SHMT2的結直腸癌病人術後總存活率低,預後差。對SHMT2 K95的乙酰化修飾促進了E3連接酶TRIM21的結合👍🏿,並導致乙酰化的SHMT2通過K63多聚泛素依賴的大自噬途徑降解👁🗨。這種修飾也削弱了結直腸癌細胞的增殖速率和成瘤能力。在誘導的小鼠腸炎模型中🧔🏿,Sirt3基因的缺失顯著降低小鼠小腸的腫瘤大小和數量。免疫組化染色表明Sirt3 敲除小鼠的腫瘤細胞中SHMT2的表達量明顯減少🦹🏻♂️。本研究還對SHMT2突變體進行了結構解析,發現SHMT2 K95突變成R/Q則破壞了SHMT2完整的功能性四聚體結構,從而降低了其對底物絲氨酸的親和,降低酶的活性🏋🏼♀️🧱。此研究揭示了SIRT3-SHMT2調控軸在結直腸癌發生中發揮的作用,為開發靶向SIRT3-SHMT2調控軸治療結直腸癌的靶向藥物提供了堅實的理論基礎。

